JCR:利用间充质干细胞体外高效制造成新生软骨
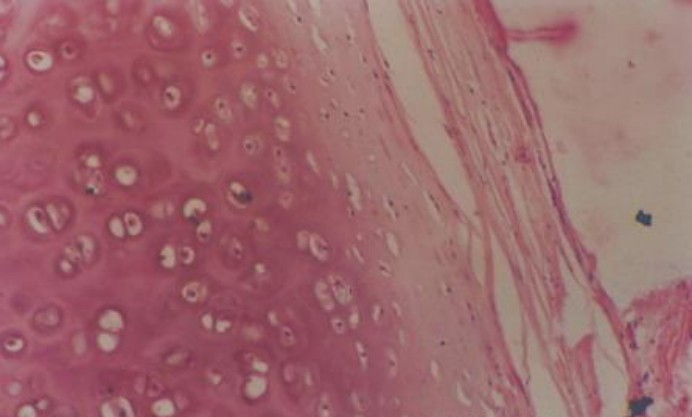
美国凯斯西储大学研究人员发现,自组装的间充质干细胞层与填充满生长因子的微小珠子浸透在一起,要比以前的组织工程方法形成更加厚和更加硬的软骨。该研究成果已经发表在《控制释放期刊》(Journal of Controlled Release)杂志上。该研究是朝开发出可移植的软骨替换又走近了一步,并给治疗由于骨关节炎(osteoarthritis)、运动损伤和事故而遭受破坏的膝、肩、耳和鼻提供了有效的途径。
生物医学工程和矫形外科系副教授Eben Alsberg,也是这篇论文的主要作者,他说,“我们认为利用病人自己的干细胞促进软骨形成的能力和使用这种无需移植前长时间培养的方法的潜力使得这种技术有吸引力”。
Alsberg和他的研究小组将转化生长因子β-1放入生物可降解的明胶微球(gelatin microsphere, 亦可翻译为明胶微珠)中,而且这些明胶微球分布在整个干细胞层上,而不是简单地将干细胞层浸没在生长因子中。Alsberg说,这种工艺表现出很多优势,当这些珠子降解时,生长因子释放出来并与干细胞层内部和外部的细胞接触,从而使得干细胞更加均匀地分化为新生软骨。
培养出的这种组织非常类似于关节软骨(articular cartilage)---在膝盖中发现的坚硬软骨:圆状的细胞被大量含有粘多糖(glycosaminoglycan, 也译为葡萄糖胺聚糖)的基质所包围,这种多糖将水离子封锁在组织中,从而使得组织具有抗压性能。测试也显示这种干细胞层含有最高量的II型胶原蛋白(collagen)---关节软骨中主要的蛋白组分。
这种工艺的一个主要的优势在于它可能避免在实验室中长时间培养软骨时所遇到的困难和高昂开销成本,相反还能允许一块软骨片更快地移植到病人身上。
来源:生物谷


